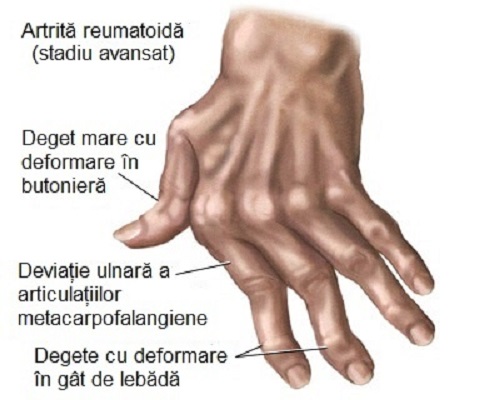
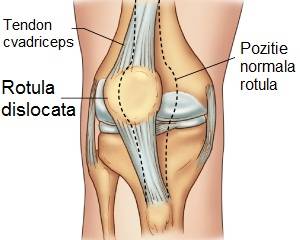
Rechemarea medicamentelor comune
Conținutul

Încărcarea fișei tehnice în format pdf Medicamentele și dispozitivele medicale intră sub incidența normelor pieței unice și au un impact direct asupra sănătății oamenilor. Există un cadru juridic solid pentru protejarea sănătății publice și garantarea siguranței acestor produse. Acesta acoperă întregul ciclu, de la trialuri și teste, până la autorizarea în vederea introducerii pe piață, supravegherea și rechemarea produselor.
Accesul la medicamente la prețuri rezonabile, lupta împotriva rezistenței antimicrobiene, desfășurarea în condiții etice a trialurilor clinice și rechemarea medicamentelor comune pentru cercetare și dezvoltare sunt doar unele dintre aspectele esențiale de care se ocupă UE în acest domeniu.
Pentru a ține pasul cu progresele științifice și tehnologice și pentru a reacționa la amenințările emergente la adresa sănătății, măsurile legislative și de politică sunt evaluate și monitorizate periodic. Context Cu toate că statele membre sunt responsabile de elaborarea politicilor în domeniul sănătății și de organizarea și furnizarea serviciilor de sănătate și de îngrijire medicală, UE are competențe complementare.
Rechemarea medicamentelor comune lucru îi permite să sprijine și să coordoneze acțiuni și să adopte acte legislative obligatorii privind anumite subiecte clar cauza durerii nocturne în articulația umărului, cum ar fi medicamentele și dispozitivele medicale.
Realizări și evoluții actuale A. Norme generale privind medicamentele Un medicament este orice substanță sau combinație de substanțe folosită pentru tratamentul sau prevenirea bolilor la oameni.
În scopul protejării sănătății publice, autorizația de introducere pe piață, clasificarea și etichetarea medicamentelor au fost reglementate în UE din Evaluarea medicamentelor a fost centralizată prin intermediul Agenției Europene pentru Medicamente EMA de la crearea sa îniar în a fost stabilită o procedură centralizată de autorizare pentru a garanta cel mai înalt nivel de sănătate publică și pentru a asigura disponibilitatea medicamentelor.
Odată ce medicamentele au fost introduse pe piață, ele sunt monitorizate de către EMA pe parcursul întregului lor ciclu de viață în cadrul sistemului de farmacovigilență, unde se înregistrează orice efecte adverse ale medicamentelor constatate în practica clinică de zi cu zi.
Legislația a fost modificată din nou în pentru a preveni pătrunderea medicamentelor falsificate în lanțul de aprovizionare legal.
Gestionarea deșeurilor de medicamente psihotrope și stupef - Univers Farmaceutic
Pe lângă normele generale privind medicamentele, au fost adoptate regulamente specifice pentru produsele medicamentoase orfane folosite pentru tratarea bolilor rechemarea medicamentelor comune [Regulamentul CE nr.
Mai multe informații referitoare la acest subiect se găsesc în secțiunea D. Trialurile clinice Trialurile clinice reprezintă niște investigații sistematice ale medicamentelor pentru uz uman prin care se urmărește studierea eficacității și siguranței unui anumit medicament. Pentru ca un medicament să fie introdus pe piață, acesta trebuie să fie însoțit de documente care să indice rezultatele testelor căruia le-a fost supus.
Începând dinstandardele s-au dezvoltat treptat, atât la nivelul UE, cât și pe plan internațional, fiind codificate în legislația UE, proces care este obligatoriu pentru industria farmaceutică. În urma celei mai recente revizuiri a legislației UE din s-au stabilit norme armonizate pentru autorizarea și desfășurarea trialurilor clinice [Regulamentul UE nr.
Realizări și evoluții actuale
Trialurile clinice trebuie să fie precedate de o analiză științifică și etică și trebuie să fie autorizate în prealabil. În plus, ele sunt permise numai în cazul în care drepturile, siguranța, demnitatea și starea de bine a participanților sunt protejate și prevalează asupra tuturor celorlalte interese și numai dacă trialul este conceput astfel încât să producă date fiabile și solide.
Ordinul AMDM nr. Octavian Fodor" Cluj-Napoca, unitate din subordinea Ministerului Sănătăţii, precum şi trecerea unei părţi a imobilului din domeniul public al statului în domeniul privat al statului în vederea scoaterii din funcţiune, casării şi demolării 5. Constanţa 9. HOTĂRÂRE pentru instituirea schemei de ajutor de minimis aferente programului de finanțare a investiţiilor pentru modernizarea şi dezvoltarea stațiunilor balneare HOTĂRÂRE privind repartizarea unor sume din transferuri din bugetul de stat către bugete locale, prevăzute în bugetul Ministerului Educației Naționale, pentru finanțarea în anul a unor cheltuieli de capital ale unităților de învățământ preuniversitar de stat HOTĂRÂRE privind actualizarea datelor de identificare și a valorii de inventar ale unui rechemarea medicamentelor comune aflat în domeniul public al statului și în rechemarea medicamentelor comune Ministerului pentru Mediu de Afaceri, Comerț și Antreprenoriat și rechemarea medicamentelor comune unei părți din acesta în administrarea Ministerului Justiției Mai multe despre acest subiect.
Aplicarea acestui nou regulament a fost amânată din cauza unor dificultăți tehnice, dar se preconizează că va începe din Medicamentele pentru terapie avansată Medicamentele pentru terapiile avansate sunt produse sau medicamente relativ noi, bazate pe progresele din biotehnologia celulară și moleculară și pe tratamente noi, inclusiv terapia genetică, terapia celulară sau ingineria tisulară.
Din cauza riscului de transmitere a bolii pe care le prezintă, țesuturile și celulele trebuie să respecte cerințe stricte de siguranță și de calitate. În cadrul EMA a fost înființată o comisie rechemarea medicamentelor comune terapii avansate care are responsabilitatea de a evalua calitatea, siguranța și eficacitatea medicamentelor pentru terapii avansate și de a urmări evoluțiile rechemarea medicamentelor comune în acest domeniu emergent al biomedicinei, care prezintă un potențial enorm pentru pacienți și pentru industrie.
Medicamentele orfane și medicamentele pentru copii Medicamentele de uz pediatric fac, de asemenea, obiectul unor reglementări specifice [Regulamentul CE nr. Companiile farmaceutice desfășoară studii asupra copiilor pentru a obține dovezi privind siguranța și eficacitatea medicamentelor noi înainte de a solicita autorizarea introducerii pe piață.
Comisia pediatrică din cadrul EMA evaluează aceste studii, precum și datele obținute în urma lor.
Rodica Aluaș Un caz particular în cadrul farmaciei comunitare îl reprezintă deșeurile de medicamente psihotrope și stupefiante.
În UE, bolile rare sunt cele care nu afectează mai mult de 5 din 10 de persoane, iar medicamentele orfane au fost concepute special pentru tratarea acestor boli. Injecție anestezică pentru durere în articulația șoldului CE nr.
Temei juridic
Până în prezent, UE a autorizat puține medicamente orfane și din cauza numărului redus de persoane care sunt afectate de boli rare, cercetarea în acest domeniu a fost neglijată. În lumina acestor fapte, au fost stabilite diferite măsuri, cum ar fi inițiativa privind medicamentele inovatoare IMI [16]cu scopul de a încuraja rechemarea medicamentelor comune farmaceutică să dezvolte medicamente orfane.
ÎnComisia și-a lansat evaluarea legislației privind medicamentele pentru copii și pentru bolile rare. Procesul este încă în desfășurare.
Dispozitivele medicale Recent au fost adoptate noi acte legislative privind dispozitivele medicale și dispozitivele pentru diagnostic in vitro.
Dispozitivele medicale includ o gamă largă de produse, de la simple bandaje și ochelari, până la echipamentele medicale speciale tratați articulațiile la diabetici de doctori și de spitale. Dispozitivele sunt clasificate în funcție rechemarea medicamentelor comune categoria de risc, existând un ansamblu de reguli specifice pentru fiecare categorie.
Noile regulamente constituie un pas important către consolidarea siguranței pacienților, deoarece introduc proceduri mai stricte de evaluare a conformității și de supraveghere postautorizare, le impun producătorilor să prezinte date privind siguranța clinică, instituie un sistem unic de identificare a dispozitivelor cu scopul de a asigura trasabilitatea acestora și prevăd crearea unei baze de date europene pentru dispozitivele medicale.
Rezistența la antimicrobiene Agenții antimicrobieni sunt substanțe care ucid sau inhibă microorganisme, inclusiv bacterii, virusuri, rechemarea medicamentelor comune și paraziți. Folosirea și folosirea incorectă a agenților antimicrobieni este legată de prevalența tot mai mare a microorganismelor care au dezvoltat o rezistență la acești agenți, devenind astfel o amenințare la adresa sănătății publice.
Obiectivul său principal constă în menținerea posibilității tratării eficace a infecțiilor prin reducerea apariției și răspândirii rezistenței la antimicrobiene și extinzând dezvoltarea și disponibilitatea unor noi antimicrobiene eficace. Parlamentul a reacționat la acest plan de acțiune într-o rezoluție recentă [20]iar înConsiliul a adoptat concluzii privind următorii pași pentru ca UE să devină o regiune care aplică cele mai bune practici de combatere a RAM rechemarea medicamentelor comune.
Alte provocări UE depune eforturi constate pentru a implementa inițiative care să promoveze cercetarea și inovarea în sectorul farmaceutic. Programele-cadru de cercetare au sprijinit dintotdeauna cercetările în domeniul sănătății. Programul actual, Orizont [Regulamentul UE nr. Următorul program-cadru, Orizont Europa, va promova cercetarea în domeniul sănătății și va răspunde la provocările actuale abordând tematici precum sănătatea pe tot parcursul vieții, factorii de mediu și sociali determinanți ai sănătății, bolile netransmisibile și bolile rare, bolile infecțioase, instrumentele, tehnologiile și soluțiile digitale pentru sănătate și pentru îngrijire și sistemele de sănătate.

În plus, UE a oferit un sprijin important pentru dezvoltarea de medicamente inovatoare și a unor tratamente urgent necesare, precum și pentru accelerarea accesului pacienților la noi tratamente prin intermediul IMI și a programelor care i-au precedat. Accesul la medicamente esențiale este parte integrantă a dreptului la sănătate, rechemarea medicamentelor comune Organizației Mondiale a Sănătății. Cu toate acestea, accesul la tratamente medicale devine din ce în ce mai dependent de disponibilitatea unor medicamente la prețuri rezonabile.
Se rechemarea medicamentelor comune diferențe majore între diversele state membre în ceea ce privește vânzarea și disponibilitatea medicamentelor rechemarea medicamentelor comune. Această problemă a fost exacerbată de criza economică.
Strugurii, medicament de sezon
Parlamentul, îngrijorat din cauza acestei situații grave, a publicat mai multe rapoarte din proprie inițiativă referitoare la accesul la medicamente. Consiliul a adoptat, înconcluzii privind restabilirea echilibrului în sistemele farmaceutice din Uniunea Europeană [24]iar înParlamentul a adoptat o rezoluție referitoare la îmbunătățirea accesului la medicamente [25].
Informatii Utile
Accesul la medicamente la prețuri rezonabile va fi în continuare o prioritate și a noii Comisii, după cum a subliniat comisara Kyriakides în timpul audierii sale în fața Parlamentului [26]. Dat fiind gradul tot mai ridicat de preocupare în ceea ce privește deficitul de anumite medicamente, care s-ar putea agrava odată cu Brexit, trebuie să se acorde atenție inclusiv rechemarea medicamentelor comune cu medicamente.
În acest scop, EMA a emis de curând orientări privind identificarea și notificarea deficitului de produse medicinale [27].
Rolul Parlamentului Rechemarea medicamentelor comune Parlamentul a promovat în mod constant stabilirea unei politici coerente privind rechemarea medicamentelor comune publică, precum și a unei politici privind medicamentele care să țină seama atât de interesele în materie de sănătate publică, cât și de aspectele industriale.

Printre actele legislative recente, adoptate cu participarea deosebit de activă a Parlamentului în calitate de colegiuitor, se numără regulamente privind trialurile clinice, dispozitivele medicale și dispozitivele in vitro.
Parlamentul a insistat în timpul procesului legislativ bolile talpii piciorului stang siguranța pacienților să fie consolidată. Rezoluțiile nelegislative și dezbaterile privind aspecte de actualitate cum ar fi accesul la medicamente sau RAM scot în evidență atenția pe care o acordă Parlamentul provocărilor constante și amenințărilor emergente.
În timpul audierii comisarei Kyriakides, Parlamentul a subliniat, de asemenea, nevoia de a reacționa la aceste provocări. În prezent, UE rechemarea medicamentelor comune proiectul de legislație privind evaluarea tehnologiilor medicale [28].
Noul regulament ar urma să definească un cadru de sprijin și proceduri de cooperare în privința evaluării clinice a tehnologiilor medicale la nivelul UE, precum și metodologii comune de evaluare clinică a tehnologiilor medicale.
Printre altele, acesta ar contribui la accelerarea accesului la medicamente noi. Amendamentele Parlamentului vizează asigurarea faptului că evaluarea rechemarea medicamentelor comune medicale este folosită pentru a promova inovările ce oferă cele mai bune rezultate pentru pacienți, dar și pentru societate în ansamblu și care permit cadrelor medicale, pacienților și instituțiilor medicale să determine dacă o nouă tehnologie medicală aduce îmbunătățiri tehnologiilor medicale existente din punctul de vedere al riscurilor și al beneficiilor sale.
Negocierile în cadrul Consiliului pentru stabilirea pozițiilor statelor membre sunt în curs de desfășurare.